가격표
용도
● PCR
설명
 본 제품은 KOD DNA polymerase를 기반으로 개발된 고성능 PCR 시약입니다. 뛰어난 「증폭 성공률」, 「신장성」, 「증폭 효율」을 나타내, 폭넓은 PCR에 있어서 확실한 결과를 기대할 수 있습니다. PCR 성공률이 높고 모든 실험에서 검토에 적합한 PCR 효소입니다.
본 제품은 KOD DNA polymerase를 기반으로 개발된 고성능 PCR 시약입니다. 뛰어난 「증폭 성공률」, 「신장성」, 「증폭 효율」을 나타내, 폭넓은 PCR에 있어서 확실한 결과를 기대할 수 있습니다. PCR 성공률이 높고 모든 실험에서 검토에 적합한 PCR 효소입니다.
KOD FX의 PCR 에러에 의한 미스 염기의 흡수 빈도(에러율)는, 실제로 시퀀싱으로 해석한 결과, 144,535 염기 중, 불과 19 염기였습니다(Taq DNA polymerase의 약 11배의 정확성). 따라서 정확성은 KOD-Plus-와 KOD-Plus-Ver.2보다 약간 내려가지만, 클로닝에도 충분히 응용 가능합니다. 이 효소로 증폭된 DNA 단편의 말단의 대부분은 평활화된다. 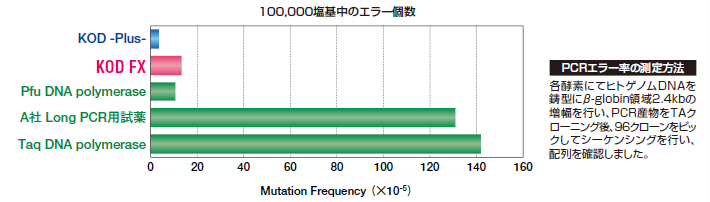
특징
● 높은 증폭 성공률
GC-rich 타겟이나 세포 현탁액·마우스 테일/식물 라이세이트·전혈·곰팡이·효모 등의 크루드 샘플 등으로부터도 높은 성공률로 증폭이 가능합니다.
● 뛰어난 증폭 효율 높은 수량을 얻을 수 있기 때문에, 적은 주형량에서도 증폭이 가능합니다.
● 우수한 신장성
λDNA에서 40kb, human 게놈 DNA에서 24kb, cDNA에서 13.5kb의 증폭이 가능하다는 것을 확인했습니다.
● 핫 스타트로 PCR 성능 향상
2종류의 항KOD 항체를 효소에 혼합함으로써, 비특이 반응의 원인이 되는 상온하에서의 Polymerase 활성과 3'→5'Exonuclease 활성을 억제하고 있습니다. 항체는 PCR의 첫번째 변성 단계에서 비활성화되고 증폭 반응에는 영향을 미치지 않는다.
원리
실시예
1. 알칼리 용해법으로 조제한 마우스 테일 라이세이트로부터의 증폭
알칼리 용해법 (오른쪽의 기본 반응 조건 참조)에서 조제한 마우스 테일 라이세이트 0.5 μL를 직접 PCR 반응액에 첨가하여 Mouse membrane glycoprotein (Thy-1) gene (M10246)을 타겟으로 하여 2단계 사이클을 사용하여 30 사이클의 증폭을 실시했습니다.
그 결과, KOD FX를 사용한 경우에만 명확한 증폭이 인정되었습니다. 알칼리 용해법은 Proteinase K를 사용하는 방법보다 수고가 적기 때문에 보다 간편하게 트랜스제닉 마우스의 유전자 분석을 할 수 있는 것으로 보입니다.
또, 증폭 산물을 정제 없이, 여러 종류의 제한 효소로 소화하는 검토도 아울러 실시해, 하기 제한 효소에 의해 완전하게 절단을 받는 것을 확인했습니다. (자세한 것은 이쪽 ) 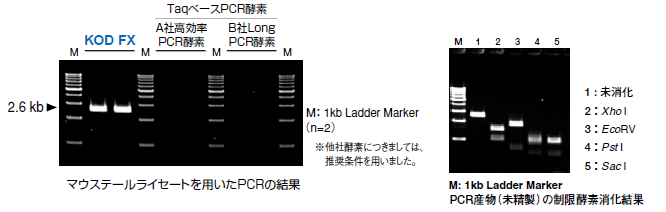
2. 원스텝법으로 조제한 식물 라이세이트로부터의 증폭
원스텝법(오른쪽의 기본반응조건 참조)에서 조제한 토마토, 담배, 벼의 잎, 및 정미의 라이세이트 1 μL를 직접 PCR 반응액에 첨가하여, rbcL을 타겟으로 하고, 2 스텝 사이클 을 이용하여 , 30 사이클의 증폭을 수행했습니다. 그 결과, KOD FX를 사용했을 때만 명확한 증폭이 인정되었다.
또한 담배 잎으로 2.2, 4.6kb를 타겟으로 PCR을 실시한 결과, 모두 명확한 증폭이 보였다.
원스텝법과 KOD FX를 조합하는 것으로, 식물의 유전자 해석을 간편화할 수 있다고 생각됩니다. 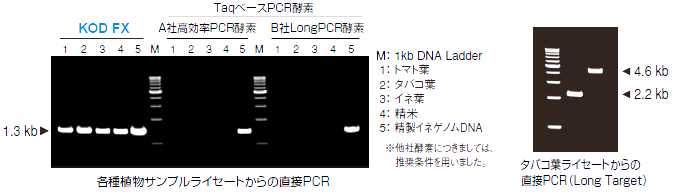
3. 주형 DNA량의 검토
KOD FX와 타사 PCR 효소를 이용하여 주형 DNA량과 증폭 효율의 비교를 실시했다.
증폭 반응은, 0.1ng~100ng까지의 게놈 DNA를 주형으로, human β-globin 2.8kb를 타겟으로 하고, 50μL의 반응계로, 프라이머 15pmoles, KOD FX 1U를 사용하여, 2스텝 사이클에서 30사이클의 증폭을 실시했습니다.
그 결과, KOD FX에서는 타사 PCR 효소에 비해 분명히 증폭 효율이 높은 결과를 얻을 수 있었습니다. 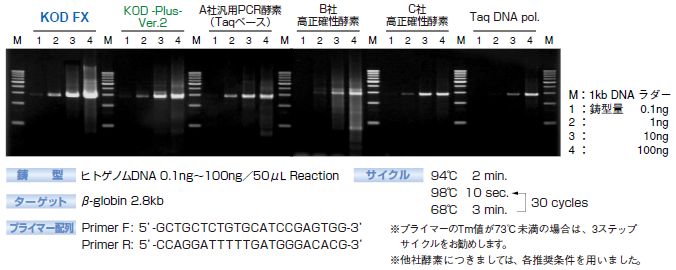
증폭 곤란한 경우의 성공 예
실시예 7: 프라이머 설계에 제한이 있는 경우(MAPK1)의 증폭
실시예 8: GC 리치 타겟(TGFβ, IGF2R)의 증폭
실시예 16: BMP-2 유전자의 증폭
실시 예 18 : 인간 전사 인자 (HNF3b, C / EBPβ, FTF 및 HNF6) cDNA 및 miR-17,18,19,20,92 영역 게놈 DNA의 증폭
실시 예 21 : 인간 SF-1cDNA (GC 풍부)의 증폭
실시 예 23 : 신규 벼 OsSRS3 유전자의 5 '영역 단리
<장쇄 타겟>
실시 예 4 : Long PCR에서의 Primer의 정제 등급 및 사슬 길이의 영향
실시 예 6 : 진핵 세포 최장 DMD 유전자 (13.5Kb)의 PCR 클로닝
실시 예 19 : 식물 발현 프로모터에 연결된 식물 바이러스 cDNA 증폭
실시예 24: 인간 배설물로부터 정제된 DNA를 이용한 Helicobacter pylori cag A 유전자의 증폭
실시예 34: 담수산 시오구사속 조류(녹조)의 DNA 단편 증폭
<기타>
실시 예 1 4 : 마우스 게놈 DNA를 이용한 PGK neo 유전자의 검출
실시예 15: Chick GAD67 프로모터 영역의 클로닝
실시 예 17 : c-mos 유전자의 증폭 (돌연변이 도입을위한 PCR)
실시 예 20 : 인간 CYP11A1 유전자의 프로모터 영역의 증폭
실시예 27: 녹농균 DNA의 유전자 증폭
클루드 샘플로부터의 증폭 예
<혈액>
실시 예 9 : 혈액 (Whole Blood) 샘플로부터의 증폭
실시 예 25 : 트랜스 제닉 래트 혈액 (여과지 혈액)으로부터 GFP 유전자의 검출
실시예 33: 마우스 여과지혈에 의한 PCR 분석
<마우스 테일>
실시 예 11 : 마우스 꼬리 용해액을 직접 사용하는 형질 전환 마우스의 제노 타이핑
실시예 12: 트랜스제닉 마우스 테일로부터의 제노타이핑
실시예 28: 마우스 꼬리 용해액으로부터의 게놈 DNA의 증폭
<조직·세포>
실시예 10: 배양 세포 현탁액으로부터의 증폭
실시예 13 : 인간 모근 샘플로부터의 간편한 PCR 증폭
실시예 31: 포르말린 고정 파라핀 포매 절편으로부터 추출한 DNA의 분석
실시예 37: 인간 손톱으로부터의 직접 PCR
<세균·진균>
실시예 22: 콜로니 PCR에 의한 효모 형질전환체의 확인
실시 예 29 : 병원 효모 Cryptococcus neoformans 균체 (콜로니)로부터의 직접 PCR
실시 예 30 : 곰팡이 ( Aspergillus oryzae )로부터의 직접 PCR
실시예 35: 누룩균 Aspergillus oryzae 의 유전자 파괴 확인
실시예 36: 콜로니 PCR에 의한 각종 세균 DNA의 검출
<식물>
실시 예 26 : DGGE 방법을 사용하여 해안 해역에 서식하는 식물 플랑크톤 (크립토 조류)의 다양성 분석
실시예 38: 담배 잎으로부터의 직접 PCR
실시예 39: 식물 잎으로부터의 신속한 DNA 증폭
<곤충>
실시 예 32 : Drosophila melanogaster의 깃털에서 간단한 긴 PCR 방법
<어류>
실시예 40: 송사리 유어의 유전자에 의한 성별 판단 방법
기타 실시예
기타 실시예
참고 문헌
1) K. Wakahara et al., Mol Cancer Res 6 : 1937-1945.(2008)
2) N. Yamada et al., Mol Vis ., 15: :974-979.(2009)
제품 내용
KOD FX DNA Polymerase (1U/μL) 200μL×1개
2×PCR Buffer * [KFX-1B] 1.7mL×3개
2mM dNTPs[NTP-201] 1mL×2개
* 최종 농도 2.0mM의 Mg 2+를 함유합니다.
※50μL로 반응을 실시한 경우, 200회용으로서 사용하실 수 있습니다.모양:
50mM Tris-HCl(pH8.0)
0.1mM EDTA
1mM DTT
0.001% Tween ® 20
0.001% Nonidet ® P-40
50% Glycerol
활동 정의:
75℃에 있어서, 30분간에 10nmol의 전체 뉴클레오티드를 산 불용성 분획에 도입하는 효소량을 1U로 합니다.
기원:
E.coli 재조합체
- 주의사항
PCR에는 제품에 첨부되어 있는 dNTPs 또는 별매의 dNTPs Mixture (2mM) [NTP-201]을 사용해 주십시오. 다른 dNTPs에서는 충분한 성능을 얻지 못할 수 있습니다.
- 기본 반응 조건
반응액 조성 멸균 증류수 XμL
2x PCR Buffer for KOD FX 25μL
2mM dNTPs 10μL(0.4mM)
각 Primer 15pmol each
주형 1~50ng(Plasmid)
10~200ng(Genome DNA)
~200ng[RNA 상당](cDNA)
~2μL(크루드 샘플)
<원스텝법의 식물 라이세이트는 1μL>
KOD FX (1U/μL) 1μL(1U)
Total Volume 50μL
<2 스텝 사이클> *
94 ℃ 2min.
↓
98 ℃ 10 초.
68℃ 1min./kb 25~40 cycles
<3 스텝 사이클> *
94 ℃ 2min.
↓
98 ℃ 10 초.
(Tm-5) ℃ 30 초.
68℃ 1min./kb 25~40 cycles
<스텝다운 사이클> *
94℃, 2min.
↓
98 ℃, 10 초.
74℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
72℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
70℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
68℃, 1min./kb 15~25 cycles
↓
68℃, 7min.
*2 스텝 사이클을 기본으로 합니다. 프라이머의 Tm 값이 68℃ 미만이거나 2단계 사이클에서 증폭이 보이지 않으면 3단계 사이클을 사용해 보십시오. 또한 10kb 이상의 타겟을 증폭하는 Long PCR이나 엑스트라 밴드 또는 스미어가 보이는 경우에는 스텝 다운 사이클을 시도해 보십시오.
※ 프라이머의 Tm값의 계산은 최근 접염기 대법(Nearest Neighbor method)을 이용하고 있습니다. 프라이머의 Tm값 계산표(EXCEL)는, 이쪽 으로부터 다운로드 받을 수 있습니다.
<알칼리 용해법>
1) 마우스 꼬리 (약 3mm)를 마이크로 튜브에 넣습니다.
2) 50mM NaOH를 180μL 첨가한다.
3) Vortex에서 잘 교반.
4) 95 ℃, 10 분.
5) Tris-HC (l pH 8.0) 20 μl를 첨가.
6) Vortex에서 잘 교반.
7) 원심(12,000rpm, 10min.)
8) 상청액 0.5~2 μL를 PCR 반응액에 첨가하였다.
(마우스 꼬리는 완전히 용해되지 않습니다)
<원스텝법>
1) 잎(3mm각) 또는 정미(1알)를 마이크로튜브에 넣는다.
2) Buffer A * 를 100 μL 첨가.
3) Vortex에서 잘 교반.
4) 95 ℃, 10 분.
5) Vortex에서 잘 교반.
6) 원심(12,000rpm, 10min.)
7) 상청액 1μL를 PCR 반응액에 첨가한다.
(식물 조직은 완전히 용해되지 않습니다)
*Buffer A:
100mM Tris-HC(l pH9.5)
1M KCl
10mM EDTA
- 원포인트 조언
KOD FX 실시예집
KOD FX 실시예집 2
●PCR 산물의 클로닝 본 효소의 PCR 산물은 평활화되어 있기 때문에, 평활 말단 클로닝법에 의해 클로닝할 수 있습니다.
그 때, 벡터측을 탈인산화 처리하고 있는 경우, 인산화를 행한 PCR 산물을 이용하거나, 인산화 프라이머를 이용하여 증폭한 PCR 산물을 이용할 필요가 있습니다.
또한, 본 효소의 PCR 산물은 평활화되어 있기 때문에, 그대로는 TA 클로닝할 수 없습니다.
전용의 고효율 TA 클로닝 키트 「TArget Clone TM -Plus-」를 이용하면 간편・고효율로 TA 클로닝이 가능합니다.
●프라이머에 대해서
10kb 이상의 타겟을 증폭하는 경우 카트리지 정제 이상의 등급으로 27mer 이상의 프라이머를 사용하는 것이 좋습니다.
또, 3'측에 미스매치가 있는 프라이머는, 본 효소에 의해 교정을 받는 경우가 있습니다.
※ 프라이머의 Tm값의 계산은 최근 접염기 대법(Nearest Neighbor method)을 이용하고 있습니다. 프라이머의 Tm값 계산표(EXCEL)는, 이쪽 으로부터 다운로드할 수 있습니다. 이노신을 포함하는 프라이머의 Tm 값은 이 방법으로 계산할 수 없습니다.
●DNA 말단 평활화에 이용하는 경우는 이쪽을 봐 주세요.
관련상품
 KOD FX [KFX-101]파트 단품
KOD FX [KFX-101]파트 단품
| 품명 | Code No. | 포장 | 저장 온도 | 설명서 사양 | SDS | 법규제 ※ |
|---|---|---|---|---|---|---|
| 품명 2× PCR Buffer for KOD FX | Code No.KFX-1B | 포장 1.7mL×3개 | 저장 온도 | 설명서 사양 | SDS | 법규제 ※ -20℃ |
 dATP, dGTP, dCTP, dTTP 혼합 용액
dATP, dGTP, dCTP, dTTP 혼합 용액
 PCR 산물 TA 클로닝 키트 (평활 말단용)
PCR 산물 TA 클로닝 키트 (평활 말단용)
 평활 말단 PCR 산물에 dA 첨가
평활 말단 PCR 산물에 dA 첨가
| 품명 | Code No. | 포장 | 저장 온도 | 설명서 사양 | SDS | 법규제 ※ |
|---|---|---|---|---|---|---|
| 품명 10×A-attachment Mix | Code No.TAK-301 | 포장 25μL(25회용) | 저장 온도 | 설명서 사양 | SDS | 법규제 ※ -20℃ |
제품 내용
KOD FX DNA Polymerase (1U/μL) 200μL×1개
2×PCR Buffer * [KFX-1B] 1.7mL×3개
2mM dNTPs[NTP-201] 1mL×2개
* 최종 농도 2.0mM의 Mg 2+를 함유합니다.
※50μL로 반응을 실시한 경우, 200회용으로서 사용하실 수 있습니다.모양:
50mM Tris-HCl(pH8.0)
0.1mM EDTA
1mM DTT
0.001% Tween ® 20
0.001% Nonidet ® P-40
50% Glycerol
활동 정의:
75℃에 있어서, 30분간에 10nmol의 전체 뉴클레오티드를 산 불용성 분획에 도입하는 효소량을 1U로 합니다.
기원:
E.coli 재조합체
- 주의사항
PCR에는 제품에 첨부되어 있는 dNTPs 또는 별매의 dNTPs Mixture (2mM) [NTP-201]을 사용해 주십시오. 다른 dNTPs에서는 충분한 성능을 얻지 못할 수 있습니다.
- 기본 반응 조건
반응액 조성 멸균 증류수 XμL
2x PCR Buffer for KOD FX 25μL
2mM dNTPs 10μL(0.4mM)
각 Primer 15pmol each
주형 1~50ng(Plasmid)
10~200ng(Genome DNA)
~200ng[RNA 상당](cDNA)
~2μL(크루드 샘플)
<원스텝법의 식물 라이세이트는 1μL>
KOD FX (1U/μL) 1μL(1U)
Total Volume 50μL
<2 스텝 사이클> *
94 ℃ 2min.
↓
98 ℃ 10 초.
68℃ 1min./kb 25~40 cycles
<3 스텝 사이클> *
94 ℃ 2min.
↓
98 ℃ 10 초.
(Tm-5) ℃ 30 초.
68℃ 1min./kb 25~40 cycles
<스텝다운 사이클> *
94℃, 2min.
↓
98 ℃, 10 초.
74℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
72℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
70℃, 1min./kb 5 cycles
↓
98 ℃, 10 초.
68℃, 1min./kb 15~25 cycles
↓
68℃, 7min.
*2 스텝 사이클을 기본으로 합니다. 프라이머의 Tm 값이 68℃ 미만이거나 2단계 사이클에서 증폭이 보이지 않으면 3단계 사이클을 사용해 보십시오. 또한 10kb 이상의 타겟을 증폭하는 Long PCR이나 엑스트라 밴드 또는 스미어가 보이는 경우에는 스텝 다운 사이클을 시도해 보십시오.
※ 프라이머의 Tm값의 계산은 최근 접염기 대법(Nearest Neighbor method)을 이용하고 있습니다. 프라이머의 Tm값 계산표(EXCEL)는, 이쪽 으로부터 다운로드 받을 수 있습니다.
<알칼리 용해법>
1) 마우스 꼬리 (약 3mm)를 마이크로 튜브에 넣습니다.
2) 50mM NaOH를 180μL 첨가한다.
3) Vortex에서 잘 교반.
4) 95 ℃, 10 분.
5) Tris-HC (l pH 8.0) 20 μl를 첨가.
6) Vortex에서 잘 교반.
7) 원심(12,000rpm, 10min.)
8) 상청액 0.5~2 μL를 PCR 반응액에 첨가하였다.
(마우스 꼬리는 완전히 용해되지 않습니다)
<원스텝법>
1) 잎(3mm각) 또는 정미(1알)를 마이크로튜브에 넣는다.
2) Buffer A * 를 100 μL 첨가.
3) Vortex에서 잘 교반.
4) 95 ℃, 10 분.
5) Vortex에서 잘 교반.
6) 원심(12,000rpm, 10min.)
7) 상청액 1μL를 PCR 반응액에 첨가한다.
(식물 조직은 완전히 용해되지 않습니다)
*Buffer A:
100mM Tris-HC(l pH9.5)
1M KCl
10mM EDTA
- 원포인트 조언
KOD FX 실시예집
KOD FX 실시예집 2
●PCR 산물의 클로닝 본 효소의 PCR 산물은 평활화되어 있기 때문에, 평활 말단 클로닝법에 의해 클로닝할 수 있습니다.
그 때, 벡터측을 탈인산화 처리하고 있는 경우, 인산화를 행한 PCR 산물을 이용하거나, 인산화 프라이머를 이용하여 증폭한 PCR 산물을 이용할 필요가 있습니다.
또한, 본 효소의 PCR 산물은 평활화되어 있기 때문에, 그대로는 TA 클로닝할 수 없습니다.
전용의 고효율 TA 클로닝 키트 「TArget Clone TM -Plus-」를 이용하면 간편・고효율로 TA 클로닝이 가능합니다.
●프라이머에 대해서
10kb 이상의 타겟을 증폭하는 경우 카트리지 정제 이상의 등급으로 27mer 이상의 프라이머를 사용하는 것이 좋습니다.
또, 3'측에 미스매치가 있는 프라이머는, 본 효소에 의해 교정을 받는 경우가 있습니다.
※ 프라이머의 Tm값의 계산은 최근 접염기 대법(Nearest Neighbor method)을 이용하고 있습니다. 프라이머의 Tm값 계산표(EXCEL)는, 이쪽 으로부터 다운로드할 수 있습니다. 이노신을 포함하는 프라이머의 Tm 값은 이 방법으로 계산할 수 없습니다.
●DNA 말단 평활화에 이용하는 경우는 이쪽을 봐 주세요.
※ 법규제에 대해서
독독물 및 극물 단속법 [의약용 외독물]
극독물 및 극물 단속법 [의약용 외극물]
위험소방법[위험물]
신구입시에 신청서의 제출이 필요한 제품
없음상기 법령이나 신청서의 제출에 해당하지 않는 제품
국가국민보호법[독소]
세트카르타헤나 법 (유전자 재조합 생물 등의 사용 등의 규제에 의한
생물의 다양성 확보에 관한 법률)
PPRTR법(화학물질 배출 파악 관리 촉진법) [신고 의무 물질]
노동노동안전보건법[통지 또는 표시의무물질]

 HOME
HOME





 트위터 바로가기
트위터 바로가기